Cell重磅(IF=45.5!)|哈佛大学研究团队直击革兰阴性菌血流感染:锁定关键酶SpeG,靶向多胺乙酰化逆转抗生素耐药

英文标题:A metabolomics pipeline highlights microbial metabolism in bloodstream infections
中文标题:代谢组学研究流程揭示血流感染中的微生物代谢特征
发表期刊:Cell
影响因子:45.5
研究背景
随着抗菌药物耐药性(Antimicrobial-Resistant, AMR)的加剧,识别细菌致病过程中可干预的代谢功能成为临床迫切需求。尽管严重感染(如血流感染)对宿主代谢的影响已被广泛研究,但微生物在感染微环境中的代谢活动长期未被重视。AMR相关感染预计于2050年导致全球每年1000万人死亡,而革兰氏阴性血流感染(Bloodstream Infection, BSI)作为主要致死原因之一,因现有抗生素靶点有限、耐药机制复杂,治疗选择亟待拓展。
这篇文章描述了一种迭代比较代谢组学的流程,以揭示宿主复杂环境中的微生物代谢特征,并将其应用于研究患者的革兰氏阴性BSI。研究团队发现,在血流感染期间,细菌来源的乙酰化多胺水平升高,并识别出了负责这些多胺生产的酶SpeG。通过阻断SpeG活性,可以减少细菌的增殖并减缓病理进程。此外,降低SpeG活性还增强了细菌膜的通透性,增加了细胞内抗生素的积累,有助于克服抗生素抗性。这项研究强调了在感染的自然背景下研究病原体代谢的工具如何揭示和优先考虑治疗策略,以应对复杂的感染。
技术路线
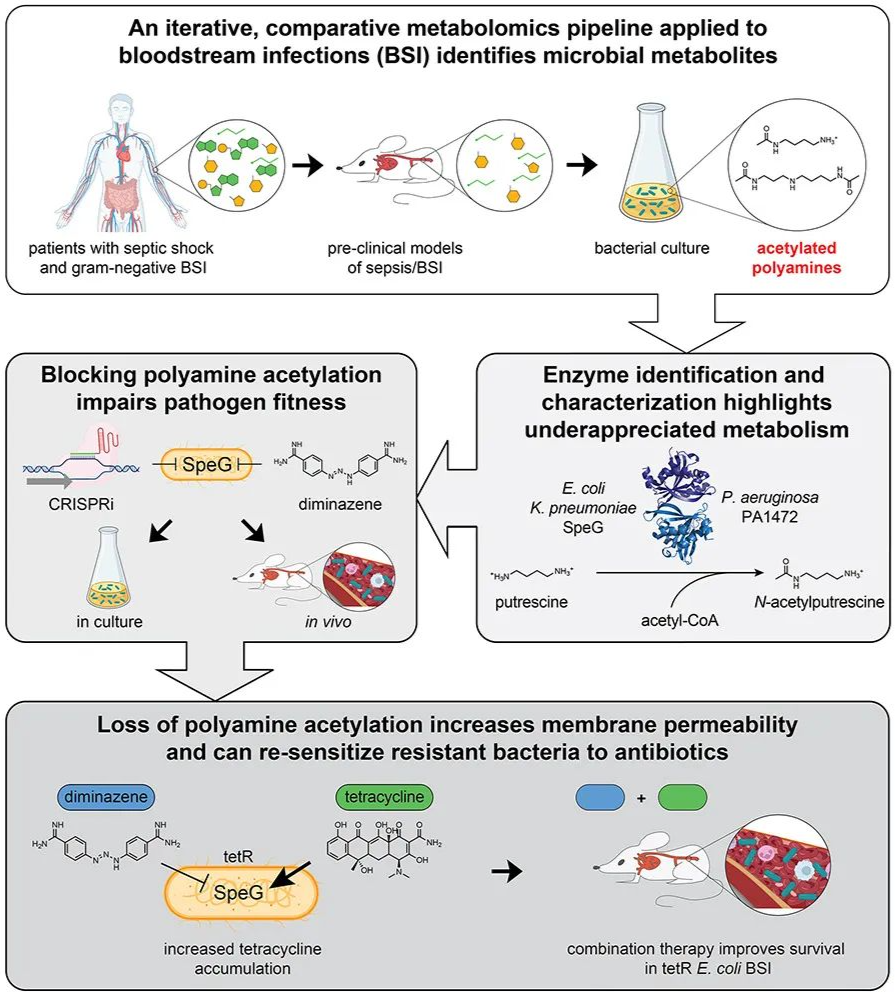
研究结果
1.通过迭代比较代谢组学流程筛选BSI中微生物来源的代谢物
为识别BSI患者血浆中升高的微生物源性代谢物,研究者设计了患者样本→小鼠模型→细菌培养的迭代比较代谢组学流程(图1A)。研究聚焦于革兰氏阴性菌(如大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌等AMR相关病原体),通过液相色谱-质谱(LC-MS)分析,在BSI患者与对照组中鉴定出62种差异代谢物,其中8种与疾病严重程度(APACHE II评分)显著相关(图1B)。
通过盲肠浆小鼠模型(活菌感染组vs.热死菌刺激组vs.无菌对照组),研究者进一步确认5种代谢物(如N-乙酰腐胺)仅在活菌感染中升高,排除宿主炎症反应的影响(图1C)。细菌培养实验显示,大肠杆菌和肺炎克雷伯菌可产生N-乙酰腐胺,而铜绿假单胞菌(包括多重耐药临床分离株)还可将其进一步生成4-乙酰氨基丁酸(图1F);小鼠体内实验表明,哺乳动物仅能微量生成类似代谢物,但可将外源N-乙酰腐胺转化为4-乙酰氨基丁酸,提示宿主可能参与部分代谢物的转化。
该流程通过 “宿主-微生物-体外培养” 多维度生物过滤,精准锁定微生物源性代谢物,为后续揭示致病菌代谢机制奠定基础。
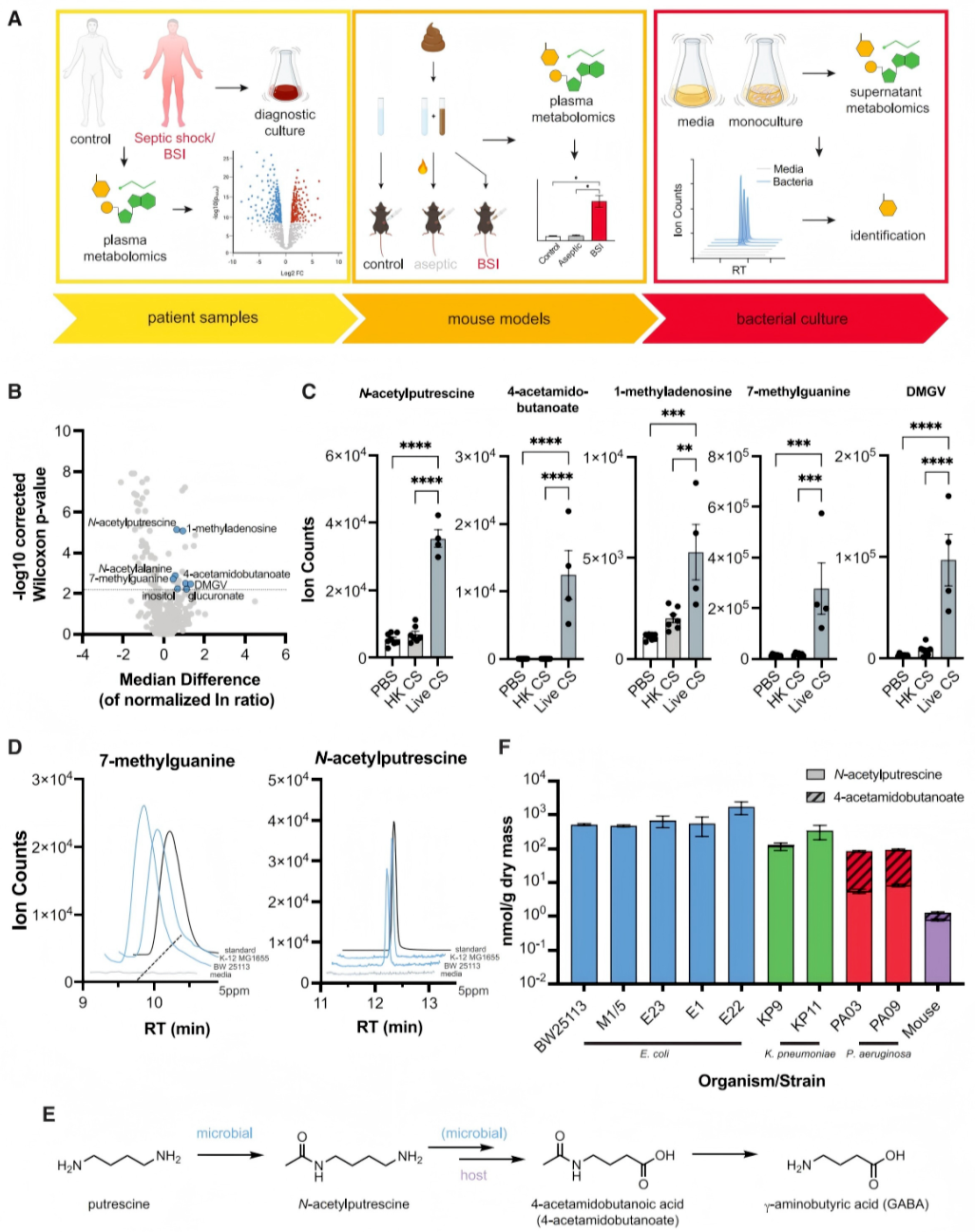
图1. 迭代比较代谢组学鉴定革兰氏阴性BSI和感染性休克患者血浆中升高的微生物代谢物
2.迭代比较代谢组学流程能够对非靶标代谢组学数据集中的特征进行优先排序
研究者利用非靶标代谢组学技术解析复杂患者样本,旨在识别细菌特有的未知代谢物(图2)。通过迭代流程对30,371个原始特征进行筛选:首先通过质量控制保留13,838个特征,利用亲水性相互作用液相色谱-正离子模式(HILIC-pos)从中选出899个差异特征;进一步通过盲肠浆小鼠模型排除宿主干扰,剩余148个特征;最终在3种大肠杆菌菌株和2种培养基条件下,确认23个特征与人类和小鼠数据一致(图2A)。
通过两项生物学标准对特征优先级排序:①与疾病严重程度评分(APACHE II)的关联性;②结合MACCARoN计算工具预测的代谢关联性。重点研究的未知特征230和114,经MS2质谱分析、核磁共振(NMR)及13C稳定同位素标记实验,分别鉴定为N1,N8-二乙酰亚精胺和2-或3-乙酰吡咯烷异构体(图2D-F)。跨模型验证显示,这些代谢物在雌性小鼠、盲肠结扎穿孔(CLP)模型及单菌株感染模型中均呈现一致变化,证实结果的稳健性。
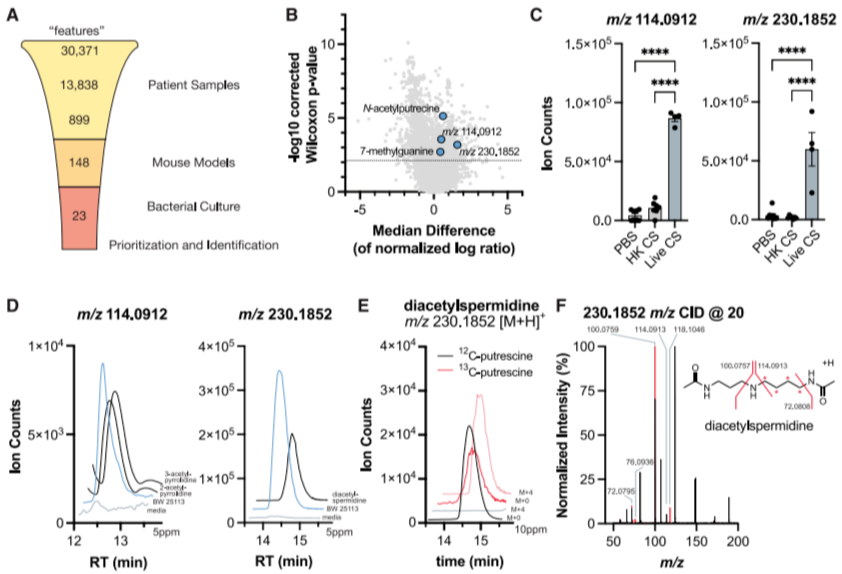
图2. 迭代比较代谢组学应用于非靶代谢组学数据,确定用于表征的其他特征的优先顺序
3.SpeG同系物在革兰氏阴性杆菌中产生N-乙酰腐胺和二乙酰亚精胺
研究者探索了BSI期间多胺乙酰化的重要性,确定SpeG同系物为革兰氏阴性菌中催化该过程的关键酶(图3)。聚焦于大肠杆菌(E. coli)中N-乙酰腐胺和二乙酰亚精胺的合成(此前其在BSI中的作用未明确),推测多胺/二胺N-乙酰转移酶为候选酶,尤其关注大肠杆菌和肺炎克雷伯菌(K. pneumoniae)普遍表达的SpeG酶。
通过敲除大肠杆菌BW25113的ΔspeG突变株,发现speG缺失导致N-乙酰腐胺和二乙酰亚精胺完全消失,而质粒互补speG基因可恢复代谢物生产(图3A)。纯化的SpeG酶可催化腐胺乙酰化,动力学显示其对腐胺具正协同机制,对亚精胺的活性接近最大速度,提示其在生理条件下主要调控亚精胺稳态。
在铜绿假单胞菌(P. aeruginosa)中,通过同源序列比对和功能互补实验,鉴定PA1472为SpeG同源物。其对腐胺的动力学参数与SpeG相似,且结构预测显示二者具高度相似性(图3H)。人类同源物SAT1对腐胺的亲和力远高于真核细胞内浓度,表明其在生理条件下对腐胺乙酰化贡献可忽略。
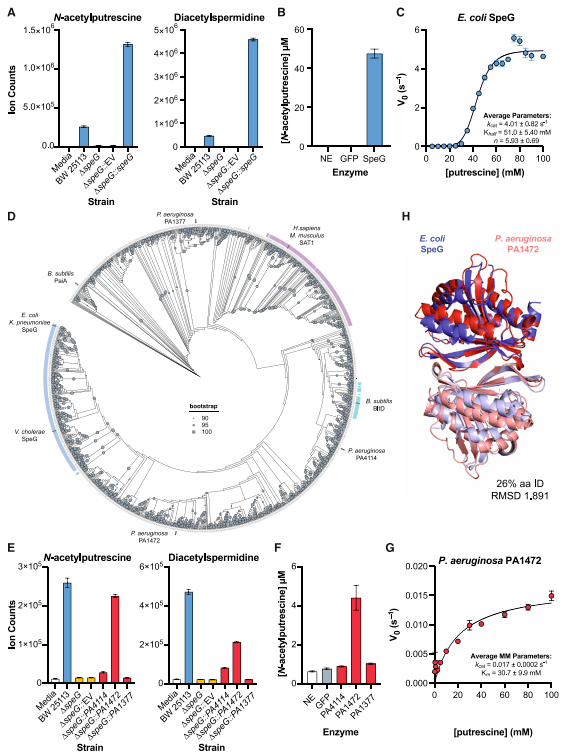
图3. SpeG同源蛋白负责革兰氏阴性病原菌中N-乙酰腐胺的生成
4.SpeG活性的丧失损害了大肠杆菌在培养和体内的适应性
多胺在调控基因表达、蛋白质翻译及细胞膜稳态中起关键作用,但其高浓度毒性需通过SpeG酶的乙酰化作用中和电荷以严格调控。SpeG缺失在不同病原体中功能差异显著:沙门氏菌中阻碍胞内增殖,耐甲氧西林金黄色葡萄球菌(MRSA)USA300株中削弱对宿主多胺的抵抗力,而志贺氏菌则通过沉默speG促进亚精胺积累以适应环境。
在大肠杆菌中,实验室菌株BW25113的ΔspeG突变株在基础培养中与野生型无增殖差异,但临床分离株(如E23、M1/5)敲低speG表达(CRISPRi系统,aTc诱导)后出现显著生长缺陷:胞外N-乙酰腐胺和二乙酰亚精胺减少,胞内腐胺积累增加。体内实验显示,抑制E. coli E23的speG表达可延迟小鼠死亡,且BW25113ΔspeG株在感染模型中脾脏菌落形成单位(CFU)显著减少,表明SpeG对病原体体内适应性至关重要。
这些发现揭示,SpeG的功能依赖于细菌遗传背景,其在临床分离株中的必需性提示多胺乙酰化是BSI中病原体代谢的关键脆弱点(图4)。
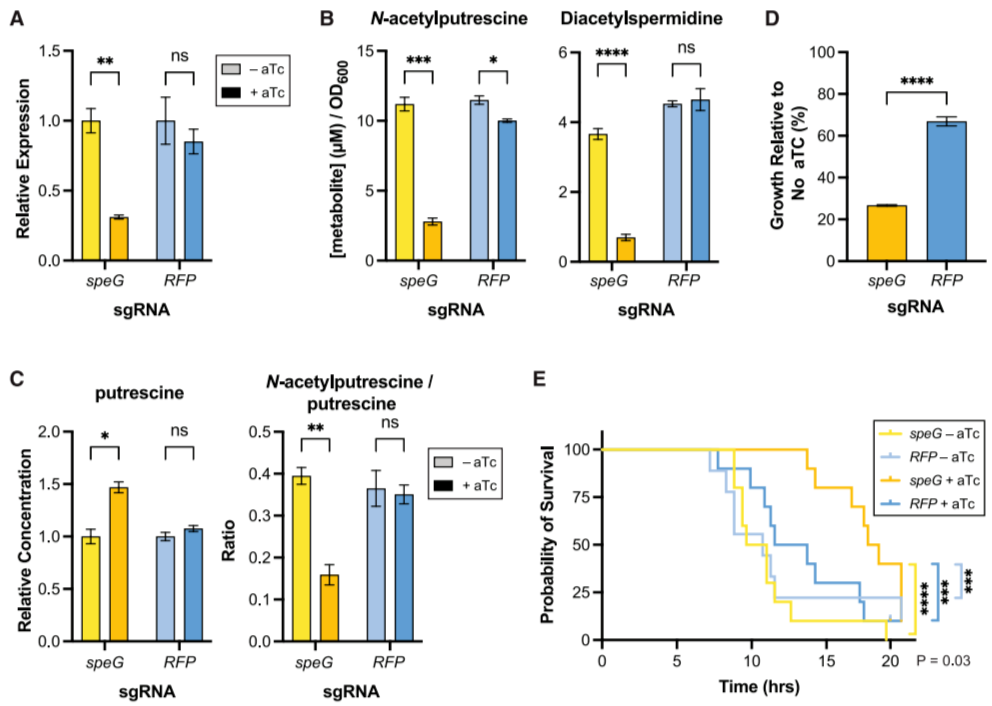
图4. 抑制SpeG表达会影响细胞增殖
5.Diminazene抑制SpeG,减少细菌增殖
尽管SpeG的小分子抑制剂尚未被报道,但人源多胺N-乙酰转移酶SAT1的抑制剂已用于抗癌研究。兽药diminazene(SAT1抑制剂)对大肠杆菌SpeG亦具抑制作用,其体外IC50为26.2±3.7 mM(以腐胺为底物),对亚精胺底物的IC50为590.1±30.8 mM,显示广谱抑制特性(图5B)。
Diminazene处理可降低胞外N-乙酰腐胺和二乙酰亚精胺水平,同时导致胞内腐胺积累、N-乙酰腐胺比例下降(图5C-D),并以剂量依赖性方式抑制细菌生长(图5E)。CRISPRi抑制speG表达后,大肠杆菌对diminazene的生长抑制产生抗性(图5F),证实其作用依赖SpeG活性。在多重耐药临床分离株中,diminazene的MIC90值显示其可作为工具化合物,用于研究多胺乙酰化在革兰氏阴性病原体中的功能(图5I-J)。需注意,diminazene对哺乳动物毒性较高,其在本研究中主要用于机制验证,而非直接作为治疗药物。
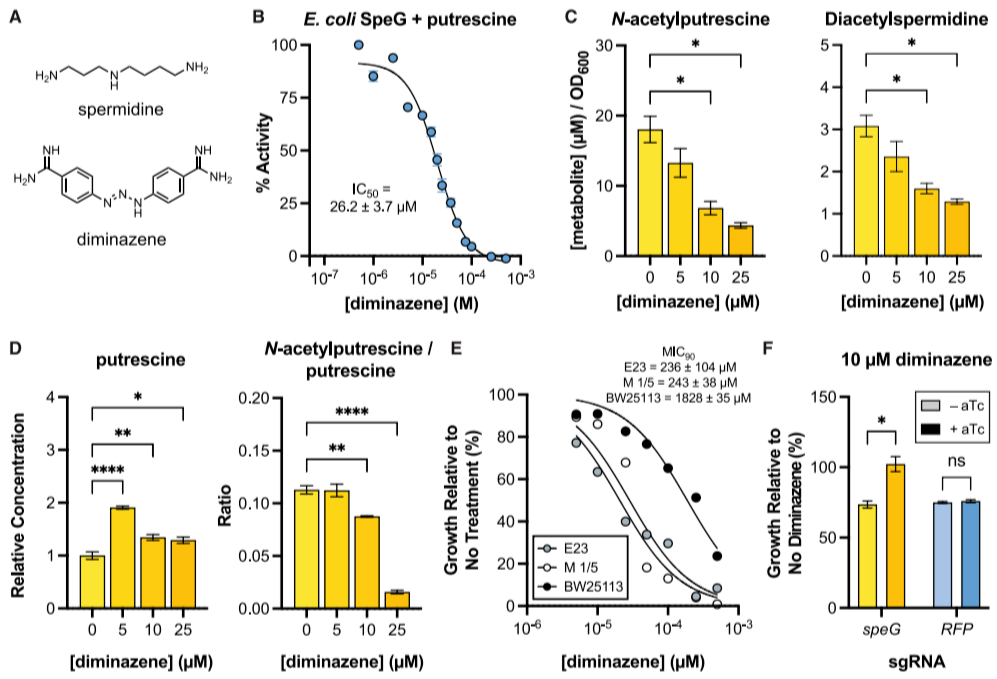
图5. diminazene抑制SpeG并模拟可诱导型CRISPRi的表型
6.抑制多胺乙酰化增加细菌膜通透性并与临床抗生素协同作用
多胺在细胞内调控DNA复制、转录、蛋白质翻译及细胞膜稳态等过程,这些路径与抗生素靶点(如DNA拓扑异构酶、膜蛋白)高度重叠。研究发现,抑制细菌SpeG酶活性可增强抗生素敏感性,其机制包括:
膜通透性增加:SpeG缺失或抑制(如diminazene处理)导致胞内腐胺积累,破坏大肠杆菌内外膜完整性。实验显示,外膜探针(NPN)和内膜探针(PI)荧光强度显著升高,表明双膜通透性增强(图6C-D)。
抗生素协同效应:万古霉素(仅作用于革兰氏阳性菌)在SpeG抑制下,MIC90从>128 μg/mL降至32-64 μg/mL,提示膜损伤使大分子抗生素得以进入胞内(图6A-B)。diminazene与四环素、环丙沙星在多重耐药(MDR)菌株中表现出协同作用,部分菌株MIC90降至临床敏感阈值以下(图7A)。
作用机制特异性:与pentamidine不同,diminazene通过抑制胞内SpeG间接诱导膜损伤,而非直接破坏外膜,其效应可被CRISPRi抑制speG完全逆转(图5F)。
体内实验证实,diminazene+四环素联合治疗可显著延长四环素耐药大肠杆菌感染小鼠的生存时间(图7C),为靶向SpeG增强现有抗生素疗效提供了跨模型证据。
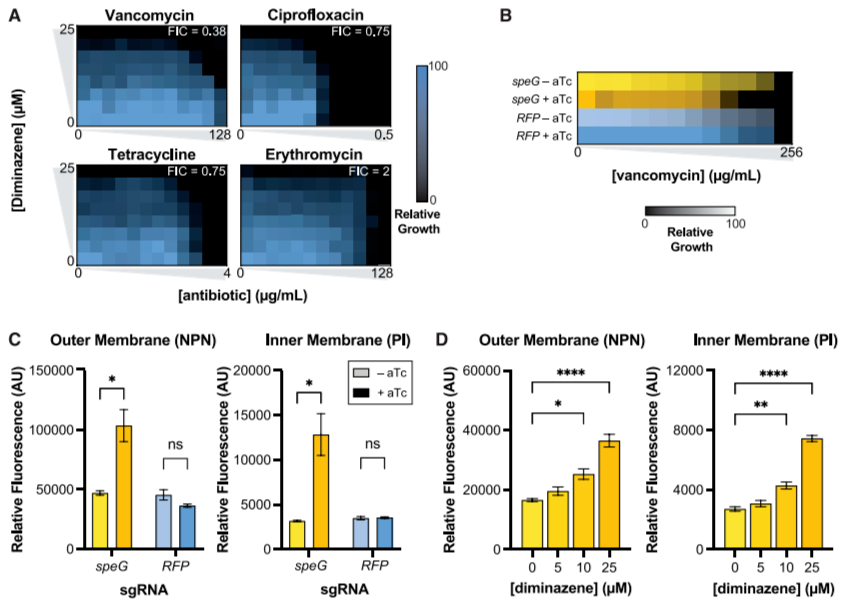
图6. 降低SpeG活性可提高膜通透性
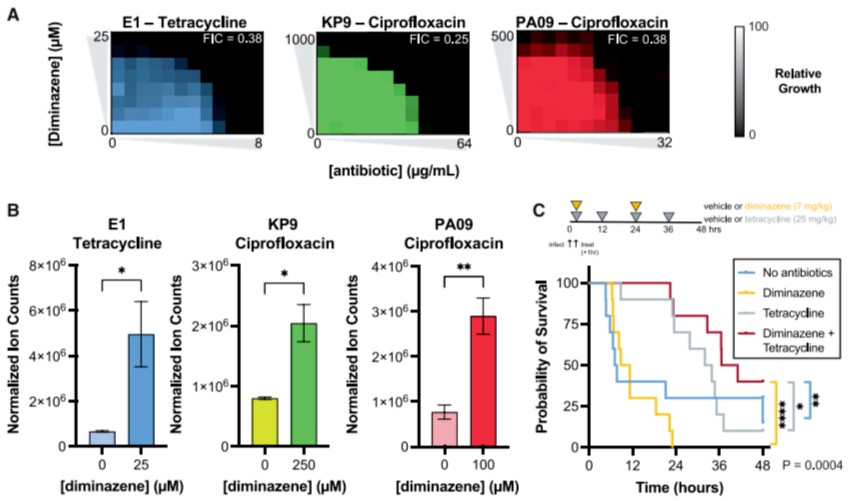
图7. 阻断SpeG在体外培养和体内实验中均能与现有临床抗生素协同作用于耐药细菌
研究结果
这项研究开发了迭代比较代谢组学流程,通过分析革兰氏阴性血流感染患者血浆、小鼠模型及细菌培养样本,鉴定出微生物特异性代谢物如N-乙酰腐胺,确认其由SpeG酶家族催化生成。SpeG在大肠杆菌、铜绿假单胞菌等病原体中通过乙酰化多胺调控膜稳态,其活性丧失会损害细菌体内外适应性。小分子抑制剂diminazene可抑制SpeG,增加细菌膜通透性,与万古霉素、四环素等临床抗生素产生协同效应,逆转多重耐药表型。研究还发现N-乙酰腐胺等代谢物可能作为BSI诊断标志物,并提出开发微生物特异性SpeG抑制剂的潜力,为应对抗生素耐药提供了新策略。
研究强调代谢组学在区分宿主与微生物代谢中的价值,通过多维度生物过滤锁定病原体关键代谢路径,结合酶动力学差异验证SpeG作为安全治疗靶点的可行性。体内实验证实diminazene与抗生素联用可提高耐药菌感染小鼠生存率,为临床干预提供了跨模型证据,凸显了靶向细菌代谢在抗耐药感染中的重要意义。
END
孔涵蕊 撰文
Tang 校稿
